Abstract
Sorption isotherms for four gases (N2, A, Kr and CO2), commonly used in specific surface area and pore structure measurements, have been accurately determined on a number of clay mineral and oxide systems.
Specific surface areas obtained by application of the BET theory to these isotherms illustrate the extent to which the apparent cross-sectional areas for these sorbed gases vary with surface structure, exchangeable cation and microporosity.
V-n plots for nitrogen adsorption on these materials using nitrogen adsorption on crystalline materials of large crystal size as a standard isotherm provide appreciable ranges of linearity in each case. The specific surface areas obtained from these straight line plots agree well with the corresponding BET values. The linearity of these plots for illite clays indicates the absence of capillary condensation and that adsorption in slit-shaped pores takes place largely by the formation of physically adsorbed layers on the surfaces.
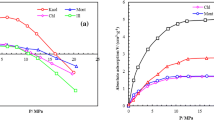
Much larger BET specific surface areas were obtained from carbon dioxide sorption at 196 K on goethite, hematite and gibbsite than from nitrogen, argon and krypton sorption at 78°K. It is suggested that enhanced sorption of CO2 into microporous regions of the oxides, inaccessible to the other gases. occurs in a similar fashion to that frequently observed for coal and charcoal materials. V-n plots for CO2 sorption in these materials using that for an illite clay as a standard isotherm, support this conclusion.
Considerably lower BET specific surface areas were obtained for CO2 sorption on kaolinite than were obtained for nitrogen, argon and krypton sorption. The shape of the V-n plots for CO2 sorption on kaolinite compared with illite suggest that an initial specific adsorption of CO2 on the kaolinite is followed by a change in state with the completion of this layer, allowing normal multilayer formation to proceed.
Résumé
Les isothermes de sorption de quatre gaz (N2, A, Kr et CO2) utilisés couramment pour les mesures de surface spécifique et de structure des pores, ont été déterminées avec précision sur un certain nombre de minéraux argileux et d’oxydes.
Les surfaces spécifiques obtenues en appliquant la théorie de BET à ces isothermes montrent bien jusqu’à quel point les surfaces projetées apparentes de ces gaz sorbés varient avec la structure superficielle, le cation échangeable et la microporosité.
Les courbes V-n pour l’adsorption d’azote sur les matériaux étudiés, en considérant l’adsorption d’azote sur des matériaux cristallins de grande taille particulaire comme une isotherme de référence, ont des domaines de linéarité appréciables dans chaque cas. Les surfaces spécifiques obtenues à partir de ces droites sont en accord avec les valeurs BET correspondantes. La linéarité de ces diagrammes pour les illites indique qu’il n’y a pas de condensation capillaire et que l’adsorption dans les pores en forme de fente se fait, pour une grande part, par suite de la formation de couches adsorbées physiquement sur les surfaces.
Des surfaces spécifiques BET beaucoup plus grandes qu’avec la sorption à 78°K de l’azote, de l’argon et du krypton, ont été obtenues avec la sorption du gaz carbonique à 196°K sur la goethite, l’hématite et la gibbsite. On fait l’hypothèse que la sorption accrue du CO2 dans la microporosité des oxydes inaccessible aux autres gaz, relève d’un processus similaire à celui que l’on observe fréquemment sur les carbones et charbons de bois. Les courbes V-n pour la sorption du CO2 sur ces matériaux étayent cette conclusion si l’on utilise l’illite comme isotherme de référence.
Sur la kaolinite, la sorption du gaz carbonique conduit à des surfaces spécifiques BET considérablement plus basses que celles que l’on obtient avec la sorption de l’azote, de l’argon et du krypton. La forme des courbes V-n pour la sorption du CO2 sur la kaolinite comparée à l’illite suggère qu’une adsorption spécifique initiale du CO2 sur la kaolinite est suivie par un changement d’état de cette couche adsorbée lorsqu’ elle est complète, ce qui permet par la suite la formation d’un système normal à plusieurs couches adsorbées.
Kurzreferat
Sorptionsisothermen für 4 Gase (N2, A, Kr, CO2), die gewöhnlich für Messungen der spezifischen Oberfläche und der Porenstruktur benutzt werden, wurden für eine Anzahl von Tonmineralen und Oxidsystemen genau bestimmt. Die spezifischen Oberflächen, die durch Anwendung der BET-Theorie auf diese Isothermen erhalten wurden, illustrieren das Ausmaß, in dem die scheinbaren Querschnittsflächen für diese Gase mit der Oberflächenstruktur, dem austauschbaren Kation und der Feinporosität schwanken.
V-n-Diagramme für die Stickstoffadsorption an diesen Stoffen unter Verwendung der Stickstoffadsorption an grobkristallinem Material als Standardisotherme liefern in jedem Fall merkliche Linearitätsbereiche. Die spezifischen Oberflächen, die von diesen linearen Bereichen der Diagramme erhalten wurden, stimmen gut mit den zugehörigen BET-Werten überein. Die Linearität dieser Kurven für Illittone zeigt, daß Kapillarkondensation fehlt und daß die Absorption in spaltförmigen Poren weitgehend durch Bildung physikalisch adsorbierter Schichten an den Oberflächen stattfindet. Viel größere spezifische BET-Oberflächen wurden aus der Kohlendioxidsorption bei 196°K an Goethit, Hämatit und Gibbsit erhalten als aus der Sorption von Stickstoff, Argon und Krypton bei 78°K. Es wird angenommen, daß die verstärkte Sorption von CO2 in die Mikroporenbereiche der Oxide, die für andere Gase unzugänglich sind, in ähnlicher Weise erfolgt, wie es häufig für Kohle und Holzkohle beobachtet wurde. V-n-Kurven für die CO2 -Sorption an diesen Stoffen unter Verwendung der für Illitton erhaltenen als einer Standard-isotherme stützen diese Schlußfolgerung. Bedeutend geringere spezifische BET-Oberflächen wurden aus der CO2-Sorption an Kaolinit erhalten als aus der Sorption von Stickstoff. Argon und Krypton. Die Form der V-n-Kurven für die CO2-Sorption an Kaolinit im Vergleich zu Illit legt nahe, daß einer anfangs spezifischen CO2-Sorption an Kaolinit eine Zustandsänderung mit der Vervollständigung dieser Schicht folgt, die es gestattet, daß die Bildung einer normalen Vielschicht abläuft.
Резюме
Изотермы сорбции четырех газов (N2, А, Кг и СО2), обычно используемых для измерения специфических площадей поверхности и структуры пор, точно определяли на ряде глинистых минералов и систем окислов. Специфические площади поверхности, полученные применением теории В.Е.Т. к этим изотермам, иллюстрируют до какой степени очевидные профили этих сорбированных газов меняются в зависимости от структуры поверхности, катионообмена и микропористости.
Для определения адсорбции азота на этих материалах построили V-n-диаграмму, используя адсорбцию азота на крупнокристаллических материалах в качестве стандартной изотермы и получили заметные области линейного изменения в каждом случае. Специфические площади поверхности, полученные посредством этих графиков прямых линий почти полностью соответствуют значениям В.Е.Т. Линейность этих графиков для иллитовой глины, указывает на отсутствие капиллярной конденсации и на адсорбцию в щелеобразных порах, происходящей большей частью вследствие образования на поверхности физически адсорбированных слоев.
Более крупные специфические площади поверхности В.Е.Т. были получены сорбцией угольного ангидрида при температуре 196°К на гетите, гематите и гибсите, чем от сорбции азота, аргона и криптона при, температуре 78°К. Предполагают, что улучшенная сорбция СО2 в микропоры окислов, недоступные для других газов, происходит таким же образом, как это нередко наблюдается с углем и древесным углем. V-n-диаграмма сорбции СО2 на этих материалах, подтверждает этой заключение.
При сорбции СО2 на каолине получили значительно меньшие специфические площади поверхности В.Е.Т., чем при сорбции азота, аргона и криптона. Форма V-n-диаграммы сорбции СО2 на каолине по сравнению с иллитом наводит на мысль, что за начальной удельной сорбцией СО2 на каолине следует изменение состояния слоя, допуская продолжение нормального образования свиты пластов.
Similar content being viewed by others
References
Anderson, R. B., Bayer, J. and Hofer, L. J. E. (1965) Determining surface areas from CO2 isotherms: Fuel 44, 443–452.
Aristov, B. C. and Kiselev, A. V. (1963) Effect of dehydration of silica surface on the adsorption isotherms for gaseous nitrogen and argon: Russian J. Phys. Chem. 37, 1359–1363.
Aylmore, L. A. G. and Quirk, J. P. (1967) The micropore size distributions of clay mineral systems: J. Soil Sci. 18, 1–17
Aylmore, L. A. G., Sills, I. D. and Quirk, J. P. (1970) Surface area of homoionic illite and montmorillonite clay minerals as measured by the sorption of nitrogen and carbon dioxide: Clays and Clay Minerals 18, 91–96.
Beebe, R. A., Beckwith, John B. and Honig, Jurgen M. (1945) The determination of small surface areas by krypton adsorption at low temperatures: J. Am. Chem. Soc. 67, 1554–1558.
Brunauer, S., Emmett, P. H, and Teller, E. (1938) Adsorption of gases in multimolecuiar layers: J. Am. Chem. Soc. 60, 309–310.
Carruthers, J. D., Payne, D. A., Sing, K. S. W. and Stryker, L. J. (1971) Specific and non-specific interactions in the adsorption of argon, nitrogen and water vapour on oxides: J. Colloid Interface Sci. 36, 205–216.
Emmett, P. H. and Brunauer, S. (1937) The use of low temperature van der Vaals adsorption isotherms in determining the surface area of iron synthetic ammonia catalysts: J. Am. Chem. Soc. 59, 1553–1564.
Foster, A. G. (1932) The sorption of condensible vapours by porous solids—I. The applicability of the capillary theory: Trans. Farad. Soc. 28, 645–657.
Gregg, S. J. and Sing, K. S. W. (1967) Adsorption, Surface Area and Porosity. Academic Press, New York.
Harkins, W. D. and Jura, G. (1944) Surface of solids X. XII and XIII: J. Am. Chem. Soc. 66, 919–927.
Harris, M. R. and Sing, K. S. W. (1967) Use of argon adsorption for the determination of specific surface area: Chem. Ind. 757–758.
Innes, W. B. (1957) Use of a parallel plate model in calculation of pore size distribution: Anal. Chem. 29, 1069–1073.
Joyner, L. G. (1958) Scientific and Industrial Glass Blowing and Laboratory Techniques (Edited by Barr, W. E. and Anhorn, V. J.), Chap. 12. Instruments Publishing Co., Pittsburgh.
Lippens, B. C. and de Boer, J. H. (1965) Studies on pore systems in catalysis—V. The t method: J. Catalysis 4, 319–323.
Pierce, Conway (1968) The universal nitrogen isotherm: J. Phys. Chem. 72, 3673–3676.
Pierce, Conway and Ewing, Bland (1964) Areas of uniform graphite surfaces: J. Phys. Chem. 68, 2562–2568.
Shull, C. G. (1948) The determination of pore size distribution from gas adsorption data: J. Am. Chem. Soc. 70, 1405–1414.
Sing, K. S. W. (1968) Empirical method for analysis of adsorption isotherms: Chem. Ind. 1520–1521.
Author information
Authors and Affiliations
Rights and permissions
About this article
Cite this article
Aylmore, L.A.G. Gas Sorption in Clay Mineral Systems. Clays Clay Miner. 22, 175–183 (1974). https://doi.org/10.1346/CCMN.1974.0220205
Received:
Published:
Issue Date:
DOI: https://doi.org/10.1346/CCMN.1974.0220205